Boletim Informativo Nº 53
Download
Dr João Paulo Nunes Fernandes
Atualmente nos Estados Unidos, mais de um milhão de adultos têm cardiopatia congênita e será inevitável que Cardiologistas Clínicos e Intervencionistas sejam expostos, conscientemente ou não a esses pacientes. A maioria dos adultos agora é encaminhado para avaliação hemodinâmica invasiva após um diagnóstico Ecocardiográfico ou história de reparo prévio. Apesar dos avanços na Ecocardiografia, Tomografia e Ressonância Magnética, o Cateterismo Cardíaco ainda oferece a vantagem de avaliar o significado hemodinâmico de uma patologia multivalvar complexa, lesões com shunt e/ou doenças miocárdica e pericárdica concomitantes. ¹
ASPECTOS TÉCNICOS
PLANEJAMENTO: A exclusão de shunts intracardíacos com significância hemodinâmica é um componente integral do CATE direito e deve ser realizado em todos os procedimentos, independentemente de a doença cardíaca congênita ser conhecida ou suspeita. Isso é particularmente importante em pacientes com aumento documentado do Ventrículo Direito e/ou Hipertensão Arterial Pulmonar. Comunicações intracardíacas, especialmente Defeitos do Septo Atrial (CIAs), e veias pulmonares anômalas podem ser facilmente perdidas na ecocardiografia transtorácica, e seu reconhecimento pode influenciar significativamente no manejo. ¹
O diagnóstico de shunts intracardíacos atualmente se baseia na ‘corrida Oximétrica’, onde a saturação de oxigênio é o marcador usado para determinar a presença e o grau de shunt. Realizar uma corrida de saturação adequada requer atenção a vários detalhes; A primeira etapa envolve o planejamento processual. Comparado com a abordagem venosa Jugular, se houver suspeita de shunt, o acesso Femoral facilita o acesso a várias estruturas diferentes: 1) o átrio esquerdo se houver um forame oval patente ou CIA, dada a orientação natural da veia cava inferior (VCI) e valva de Eustáquio em direção ao septo atrial; 2) ambas as veias cavas, uma vez que a canulação da VCI às vezes pode ser demorada em uma abordagem jugular; e 3) veias pulmonares anômalas drenando para a veia cava superior (VCS) ou veia inominada, pois não raramente uma bainha colocada na veia jugular interna se situaria distalmente à sua drenagem. O acesso femoral também permite o uso de 2 bainhas venosas (ou seja, 2 cateteres diagnósticos), o que minimiza a manipulação dos dispositivos e os intervalos de tempo entre as coletas de sangue. Isso é particularmente útil quando vários passos ou intervenções diferentes são antecipados (por exemplo, administração de O² a 100% ou Óxido Nítrico, quando há Ventrículos Direitos grandes e, portanto, com difícil acesso à artéria pulmonar, onde um cateter pode ser deixado no ramo da artéria pulmonar, enquanto o outro pode ser usado para amostrar os outros locais e também quando o acesso a uma veia pulmonar for a etapa mais desafiadora, sendo um cateter mantido nessa estrutura enquanto o segundo é manobrado). ¹
Ao realizar a Corrida Oximétrica, é fundamental que todas as amostras sejam coletadas no menor intervalo de tempo possível (idealmente em 5 minutos) para se evitar um diagnóstico errôneo de shunt devido a variações normais no débito cardíaco ou saturação arterial de O². Isso é especialmente importante em pacientes sob Sedação, que podem apresentar Apnéia Obstrutiva ou Hipoventilação intermitentes, alterando drasticamente as pressões intracardíacas e os níveis de O². Para encurtar o intervalo de tempo entre as amostras e aumentar a precisão da corrida recomenda-se iniciar a coleta seriada na artéria pulmonar distal, amostrando posteriormente as câmaras mais proximais à medida que o cateter é recuado, sempre aspirando um volume suficiente (+/- 5 mL) para limpar todo o cateter de sangue ou soro fisiológico previamente colhidos. Outros passos importantes devem ser seguidos para se ter uma Corrida Oximétrica adequada, tais como:
- Incluir amostras das Veiais Cava Inferior e Cava Superior, Átrio Direito, Ventrículo Direito, ramo da Artéria Pulmonar e Artéria Sistêmica (que deve ser coletado simultaneamente com a amostra da Artéria Pulmonar). ¹
- A amostra da Veia Cava Inferior deve ser obtida um pouco abaixo do diafragma, com o cateter direcionado medialmente (voltado à coluna) para evitar o fluxo da veia hepática, o fluxo de uma CIA para a VCI ou retorno venoso Pulmonar anômalo na junção cavoatrial inferior. ¹
- A Veia Cava Superior deve ser amostrada 1 a 4 cm acima da junção cavoatrial com a ponta do cateter voltada lateralmente para evitar o fluxo da veia ázigos. ¹
- Amostra do Átrio Direito deve ser obtida da porção média da câmara com o cateter também voltado para a lateral para evitar fluxo do seio coronário. ¹
CALCULANDO OS FLUXOS SISTÊMICO E PULMONAR: Na presença de um shunt intracardíaco, o cálculo do débito cardíaco por termodiluição não deve ser utilizado, pois este método requer uma mistura adequada entre o sangue e o infundido. Além disso, a termodiluição na presença de um shunt da esquerda para a direita não mede o “débito cardíaco” (Qs) e sim o fluxo sanguíneo pulmonar (Qp) e, se elevado, pode sugerir a presença de um defeito intracardíaco. Os fluxos pulmonar e sistêmico devem ser medidos pelo método de Fick com medição direta do consumo de O² sempre que possível (Tabela 1). A contribuição de O² dissolvido é insignificante em pacientes que respiram ar ambiente e às vezes é omitida dos cálculos. No entanto, sua contribuição torna-se significativa quando se administra O² a 100%; A gasometria sanguínea com medida da pressão parcial de O² deve ser então realizada em todas as amostras venosas, exceto as mistas. Alternativamente, se a pressão parcial de O² não puder ser medida diretamente, o conteúdo de O² dissolvido pode ser estimado em 1,7 g% em pacientes com Sat Arterial O² = 100% enquanto se administra 100% de O². ¹,²
O cálculo do fluxo pulmonar (Qp) requer amostragem da artéria pulmonar e das veias pulmonares. A saturação venosa pulmonar deve sempre ser medida diretamente se houver comunicação atrial; em pacientes com septos atriais intactos, isso terá que ser estimado. Se a saturação arterial for normal (>95%), o valor arterial pode ser usado como saturação da veia pulmonar. O enigma surge quando uma dessaturação arterial sistêmica está presente; uma saturação arbitrária da veia pulmonar de 95% é normalmente usada, mas isso pode levar a um diagnóstico falso de shunt direito-esquerdo em pacientes com doença pulmonar e incompatibilidade ventilação-perfusão. A injeção intraprocedimento de solução salina agitada com ecocardiografia simultânea pode ser útil; se a dessaturação arterial estiver presente e os resultados de um estudo de bolhas forem negativos, pode-se presumir com segurança que o O² venoso e arterial são concordantes e, portanto, podem ser usados alternadamente. Também é importante lembrar que a saturação em cunha da artéria pulmonar deve ser sempre >95% mesmo na presença de doença pulmonar ou shunt intracardíaco e, portanto, não deve ser usada como substituto da saturação venosa pulmonar. ¹,²
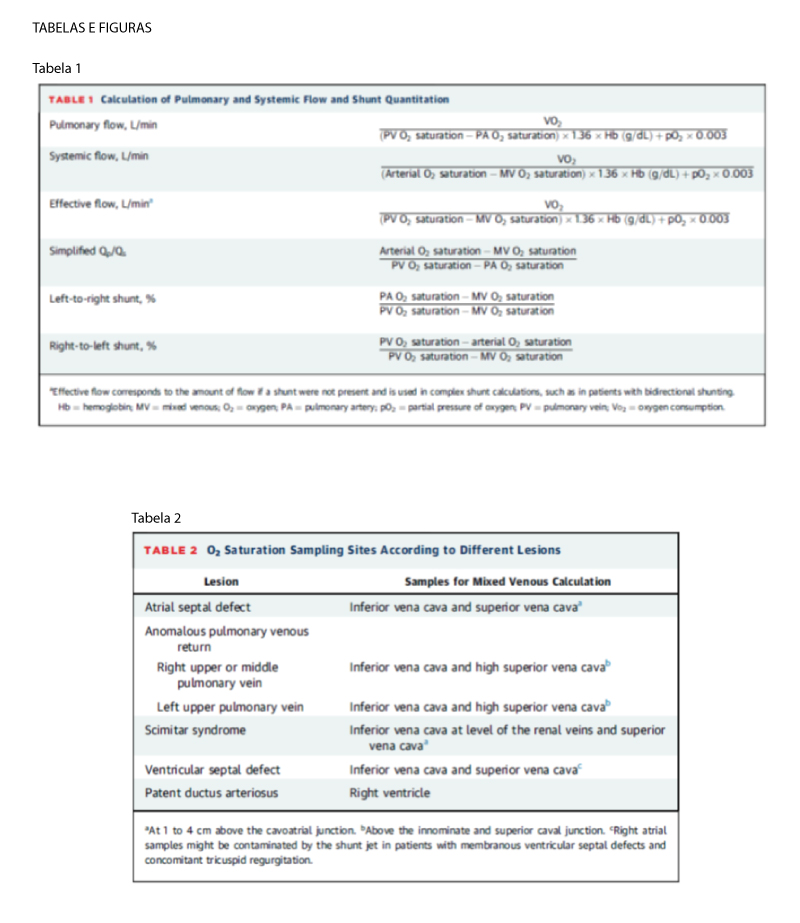
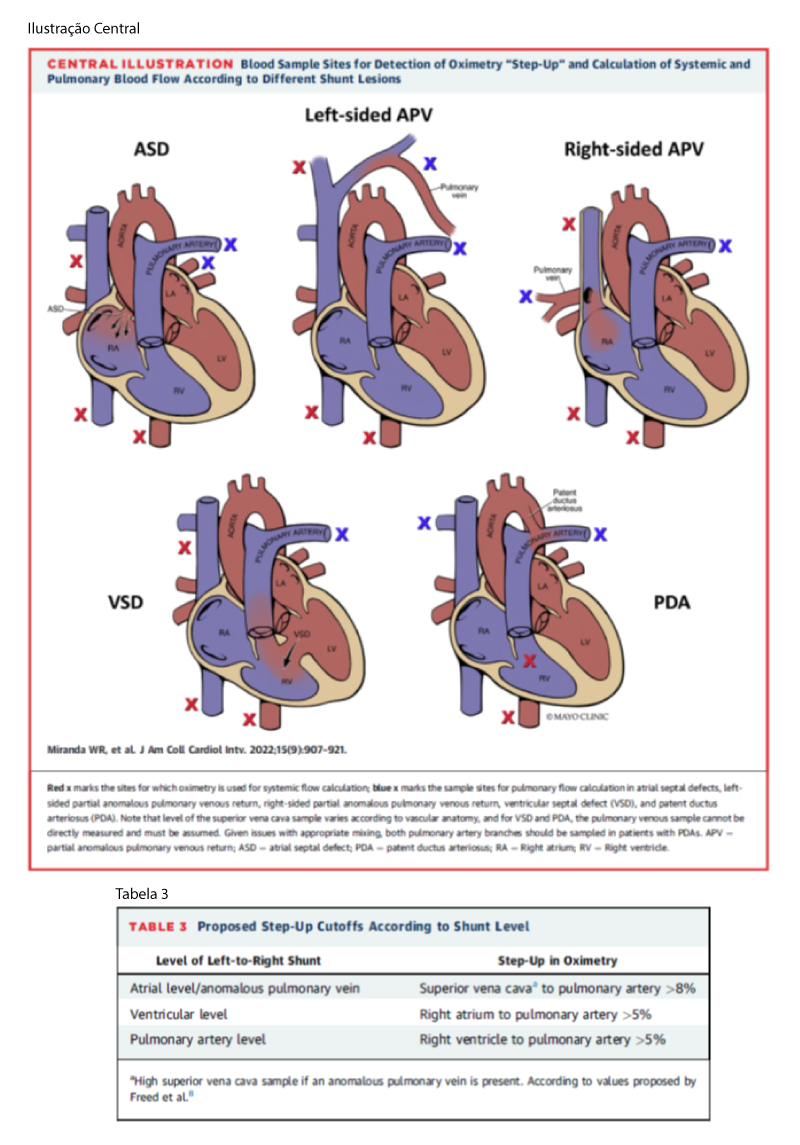
A confusão ocorre mais comumente durante o cálculo do fluxo sistêmico (Qs), normalmente devido à determinação da mistura venosa. Para isso, a amostra também deve ser coletada “antes” ou seja, proximal a câmara que o shunt ocorra e, portanto, mudará de acordo com a lesão subjacente. A Tabela 2 e a Ilustração Central resumem quais amostras devem ser usadas para cada defeito específico. Outro tema controverso é a incorporação da saturação da VCI no cálculo do valor venoso misto em pacientes com CIA. ¹ De acordo com a publicação original de Dexter e cols., a maioria dos procedimentistas pediátricos usará rotineiramente apenas a saturação da VCS. A justificativa para não incluir a amostra de VCI está relacionada ao alto grau de variabilidade observado nessas amostras, pois refletem diferentes quantidades de sangue venoso renal altamente saturado e retorno venoso hepático insaturado. Essa abordagem, no entanto, tem sido questionada em adultos, nos quais a contribuição da VCS para o retorno venoso sistêmico é <50%. Assim, em laboratórios de adultos, a fórmula de Flamm ([3xVCS + VCI]/4) é frequentemente aplicada, pois demonstrou melhor correlação com amostras de artéria pulmonar em adultos. Alternativamente, French e cols. demonstraram que uma fórmula que favorece a VCI ([VCS + VCIx2]/3) aproxima com mais precisão a saturação arterial pulmonar em adultos, visto que dois terços do retorno venoso sistêmico em adultos são provenientes da VCI. No entanto, dados surpreendentemente limitados estão disponíveis comparando esses diferentes métodos com o tamanho do shunt e o aumento da câmara. Se a amostra de VCI for incorporada ao cálculo, Qp/Qs normalmente será um pouco menor do que o calculado usando apenas a saturação de VCS. ¹,²
Para a amostra arterial, a saturação de O2 arterial mais periférica (isto é, femoral) é normalmente escolhida, mas na ausência de defeito do septo ventricular com shunt bidirecional, a amostra do ventrículo esquerdo pode ser usada se extraída mais próxima da amostra da artéria pulmonar. Ressalta-se que em situações em que não há shunt, um erro comum é utilizar a saturação da VCS para cálculo de Qs quando a saturação da artéria pulmonar é menor. Isso cria artificialmente Qs mais altos do que Qp ou um aparente shunt da direita para a esquerda. ¹,²
DIAGNÓSTICO DE UM SHUNT PELA OXIMETRIA: Após a obtenção das amostras de oximetria, o próximo passo é determinar se um shunt está presente. Com base nos valores esperados em indivíduos normais submetidos a cateterismo cardíaco, diferentes “saltos Oximétricos” têm sido propostos para o diagnóstico de shunt esquerda-direita de acordo com o local de amostragem; estes estão resumidos na Tabela 3. Embora atualmente avaliada por diferenças na saturação de O² (ou seja, porcentagem), a avaliação do shunt também pode ser realizada usando o teor de O² (porcentagem de volume), como inicialmente proposto por Dexter e cols.3; os “saltos oximétricos” esperados no nível atrial, ventricular e da artéria pulmonar foram de 2, 1 e 0,5 vol%, respectivamente. Deve-se destacar que pequenos shunts (Qp/Qs <1,3) não serão detectados pela oximetria e, portanto, uma corrida de saturação “normal” não descarta totalmente um shunt (mas argumenta contra seu significado hemodinâmico). Se a presença de “salto oximétrico” for questionável, uma segunda série de amostras deve ser obtida (primeira amostragem da artéria pulmonar e, posteriormente, amostragem das câmaras mais proximais à medida que o cateter é retirado). Por esse motivo, os dados oximétricos devem sempre ser revisados antes da retirada do cateter venoso diagnóstico, evitando assim o reconhecimento de um shunt ou amostras imprecisas e/ou não diagnósticas pós-procedimento. ¹,²
Em pacientes com dessaturação sistêmica, a presença de um shunt direita-esquerda será sugerida por uma queda na saturação de O2, tipicamente >3% (por exemplo, uma queda na Saturação de O² das veias pulmonares para o ventrículo esquerdo num shunt bidirecional ao nível atrial). Como mencionado anteriormente, se o átrio esquerdo não puder ser acessado, o diagnóstico de shunt direito-esquerdo em nível intracardíaco não pode ser feito apenas pela oximetria e o uso do estudo ecocardiográfico com solução salina agitada fornecerá informações incrementais. ¹,²
Uma vez que todas as saturações de O² tenham sido obtidas, o grau de shunt pode ser quantificado (incluindo a porcentagem de shunt esquerda-direita e direita-esquerda) (Tabela 1). Embora o cálculo de Qp ou Qs exija a incorporação de outros componentes (Consumo de O² e hemoglobina), o cálculo de Qp/Qs pode ser obtido usando a fórmula simplificada demonstrada na tabela 1. Esta fórmula simples pode ser usada para estimar um shunt durante a coleta de dados no laboratório de cateterismo. De forma que Qp/Qs >1 é visto na presença de shunts da esquerda para a direita, sendo que Qp/Qs <1,5 representa shunt E-D pequeno, Qp/Qs de 1,5 a 2,0 um shunt moderado e Qp/Qs > 2,0 com shunt importante. Em pacientes com shunts da Direita para a Esquerda o Qp/Qs será < 1,0. ¹,²
CALCULANDO A RESISTÊNCIA PULMONAR: Para a resistência vascular pulmonar, semelhante aos pacientes com cardiopatia adquirida, as diferenças entre a pressão média da artéria pulmonar e a pressão atrial esquerda ou PAWP fornecerão o numerador da equação. Na presença de um shunt intracardíaco, é obrigatório que Qp em vez de Qs seja incorporado à equação. O uso errôneo de Qs levará a uma superestimação da resistência vascular pulmonar em pacientes com shunts da esquerda para a direita e subestimação da resistência verdadeira naqueles com shunts da direita para a esquerda. A resistência vascular pulmonar é tipicamente relatada em WU (unidades Wood) ou como WU/m² se indexada à área de superfície corporal. ¹,²
A resistência vascular sistêmica é calculada pela fórmula (PAM - PAD média)x1.332x60/Qs, (expressa em dinas/s/cm-5, onde 1 WU = 80 dinas/s/cm-5). Alternativamente, a resistência vascular sistêmica total (Rs) pode ser calculada usando a fórmula PAMx1.332x60/Qs. Assim como no cálculo da resistência vascular pulmonar, em pacientes com shunts, deve-se garantir que Qs ao invés de Qp seja usado como numerador, caso contrário a resistência vascular sistêmica será subestimada naqueles com shunts D-E, ocorrendo o contrário naqueles com shunts E-D. ¹,²
CATETERISMO CARDÍACO E AVALIAÇÃO HEMODINÂMICA EM SITUAÇÕES ESPECÍFICAS
DEFEITOS DO SEPTO ATRIAL: O aumento do Ventrículo Direito está tipicamente presente em pacientes com CIA e Qp/Qs >1,5. O CATE direito raramente é realizado hoje em dia para o diagnóstico de CIA não complicada, sendo os pacientes encaminhados diretamente ao fechamento percutâneo com implante de uma prótese com base no achado por método não invasivo do Defeito do Septo Atrial, Qp/Qs > 1,5 e aumento ventricular direito. ³
O fechamento pode ser considerado naqueles com Qp/Qs >1,5, PSAP >50% da pressão sistólica arterial sistêmica e/ou resistência vascular pulmonar maior que um terço da resistência vascular sistêmica. Devido às incertezas e ao aumento do risco de fechamento de CIA nesse grupo específico de pacientes devido ao grau de elevação das pressões pulmonares, eles são frequentemente encaminhados para cateterismo e, portanto, cálculos precisos de shunt e resistência vascular pulmonar são um componente crítico na avaliação clínica e manejo dos pacientes. ³
A avaliação de pacientes elegíveis ao fechamento se torna mais complexa naqueles com hipertensão arterial pulmonar Moderada ou Acentuada e que já tenham inversão do shunt (da Direita para Esquerda). No passado, acreditava-se que esses pacientes apresentavam risco proibitivo, porém dados crescentes sugerem uma resposta benéfica à terapia com vasomoduladores pulmonares e ainda há controvérsia sobre as consequências a longo prazo da abordagem “tratar e fechar”. Preocupações também foram levantadas em relação ao risco de fechamento da CIA em pacientes com doença cardíaca esquerda concomitante (por exemplo, disfunção diastólica), pois o fechamento pode precipitar elevações na pressão do átrio esquerdo e edema pulmonar. Dada a complexidade desse subconjunto de pacientes, eles devem ser avaliados e conduzidos em centros com experiência em intervenção complexa em cardiopatias congênitas. 4
DRENAGEM ANÔMOLA PARCIAL DAS VEIAS PULMONARES: Do ponto de vista fisiológico, as veias pulmonares anômalas mimetizam as CIAs, resultando em aumento do átrio e ventrículo direitos. No entanto, há uma diferença muito importante: na presença de um Septo Interatrial íntegro, as veias pulmonares anômalas representam obrigatoriamente shunts da esquerda para a direita. Podem ocorrer isoladamente ou com um defeito do septo interatrial concomitante (tipicamente seio venoso e menos comumente secundum). Conexões venosas pulmonares anômalas parciais devem ser suspeitadas quando a saturação de O² da VCS é maior que na VCI, pois a maioria das veias anômalas drena para VCS ou veia Inominada. 1,3
Para a quantificação adequada do shunt, é fundamental que a própria veia pulmonar anômala seja canulada (para medição da saturação de O² da veia pulmonar e Qp) (Figura 2) e que uma amostra de VCS ou mesmo jugular (coleta acima da drenagem da veia inominada) seja obtida para determinação da saturação venosa mista e cálculo de Qs. A presença de ≥2 veias anômalas do lado direito ou uma veia lingular e uma superior esquerda grande pode resultar em Qp/Qs entre 1,5 e 2,0, enquanto uma única veia anômala do lado direito ou veia pulmonar superior esquerda isolada tende a estar associada a Qp/Qs ≤1.5. 1,3
DEFEITO DO SEPTO INTERVENTRICULAR: Na prática atual, o cateterismo diagnóstico é reservado para pacientes com Ventrículo Esquerdo aumentado e graus questionáveis de shunt (baseado nos dados não invasivos) ou naqueles com defeitos moderados nos quais a pressão sistólica do ventrículo direito não pode ser estimada com precisão pelo ecocardiograma. Se a dilatação do Ventrículo Esquerdo estiver de fato relacionada ao defeito do septo ventricular, geralmente o Qp/Qs estará entre 1,5 e 2,0. Em contrapartida, Qp/Qs <1,5 argumenta contra um shunt E-D como etiologia da sobrecarga da câmara do lado esquerdo. Um grande defeito do septo ventricular no adulto (na ausência de estenose pulmonar grave) está associado à hipertensão pulmonar acentuada e tipicamente à fisiologia de Eisenmenger. Dada a complexidade dos cálculos hemodinâmicos do shunt (que invariavelmente é bidirecional), o cateterismo cardíaco nesses pacientes deve ser realizado por um operador experiente com cardiopatia congênita complexa. 1,3
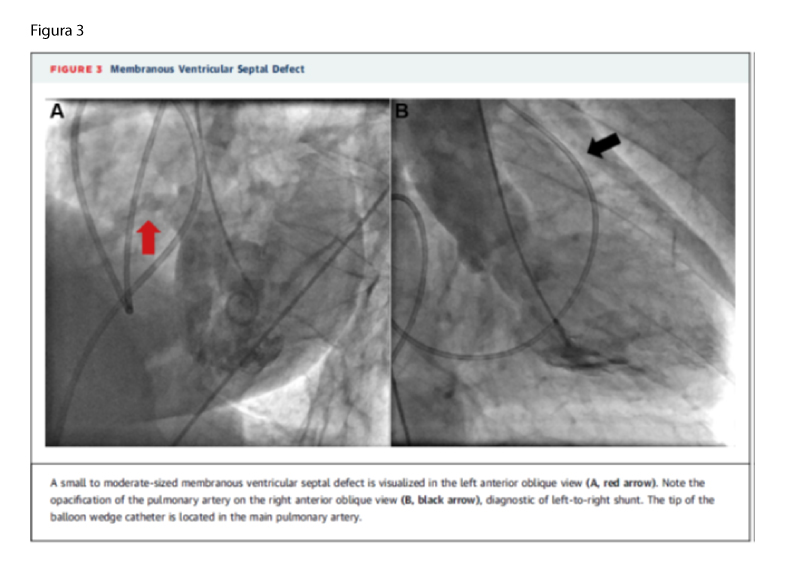
A ventriculografia esquerda pode fornecer dados diagnósticos adicionais nos pacientes com CIV suspeito ou conhecido (Figura 3), detectando CIVs pequenos e hemodinamicamente insignificantes em pacientes que não possuem salto oximétrico e possibilitando a medida do tamanho do defeito ao se aferir na angiografia Oblíqua Anterior Esquerda a Vena Contracta do defeito do septo ventricular. 1,3
PERSISTÊNCIA DO CANAL ARTERIAL: Adultos com PCA raramente são encaminhados para CATE diagnóstico e na presença de Canal Arterial hemodinamicamente significativo com evidência de sobrecarga de volume à esquerda, o fechamento percutâneo é normalmente realizado devido à baixa morbidade e alta taxa de sucesso. Muitos adultos com PCA de tamanho moderado ainda podem ter grandes shunts da esquerda para a direita e baixa resistência vascular pulmonar, permitindo seu fechamento. Ao contrário de outras lesões com shunt, o cálculo do Qp/Qs em pacientes com PCA não é realizado, devido a mistura incompleta de sangue em amostras de artéria pulmonar e consequente imprecisões na estimativa do tamanho do shunt. 1,3
Adultos com PCAs grandes apresentarão hipertensão arterial pulmonar grave e fisiologia de Eisenmenger, observando-se neste cenário uma redução na saturação de O² entre aorta ascendente ou Ventrículo Esquerdo e a amostra da artéria femoral. Nesses pacientes, o cateter venoso frequentemente canula o PCA a medida que avança nas artérias pulmonares e pode ser a primeira evidência de PCA em pacientes com hipertensão pulmonar “idiopática”. 1,3
ESTENOSE PULMONAR: Assim como nos CIVs e PCAs, atualmente os pacientes com estenose valvar pulmonar isolada raramente são encaminhados para CATE diagnóstico. Sua avaliação invasiva é tipicamente feita naqueles encaminhados à Valvotomia Pulmonar Percutânea por Balão. O grau de estenose é baseado na medida do gradiente sistólico pico a pico, sendo que gradientes >35 mmHg são consistentes com obstrução grave e valores
COARCTAÇÃO DA AORTA: O diagnóstico de CoAo com significância hemodinâmica é baseado em um gradiente sistólico pico a pico ≥ 20 mmHg na área de estreitamento. A determinação da importância hemodinâmica da CoAo (ou recoarctação) é complexa e envolve dados não invasivos, em repouso e exercício, e Angiotomografia. A avaliação do gradiente de coarctação no CATE pode parecer enganosamente simples em algumas situações, pois são fortemente afetados pelo estado hemodinâmico subjacente (normotensão x hipertensão), presença de grandes vasos colaterais, nível de sedação e uso de anestesia geral. Portanto, deve-se lembrar que estes pacientes podem ter incompatibilidade entre os gradientes esperados e medidos no momento da avaliação invasiva. 1,3
TRANSPOSIÇÃO DAS GRANDES ARTÉRIAS: A prevalência de pacientes sintomáticos com transposição das grandes artérias e Ventrículo Direito sistêmico vem aumentando à medida que esses indivíduos envelhecem, pois a disfunção sistólica sistêmica progressiva do VD e a insuficiência cardíaca são complicações bem estabelecidas em longo prazo. Independentemente destes pacientes apresentarem correção congênita ou transposição completa das grandes artérias (D-transposição) após a confecção do switch atrial, a artéria pulmonar é posterior à aorta. Como resultado dessa relação entre as grandes artérias, o acesso à artéria Pulmonar pode ser desafiador, principalmente pelo acesso venoso femoral. Portanto, o acesso jugular interno direito pode oferecer um caminho mais fácil às artérias pulmonares, pois a ponta do cateter normalmente se curva posteriormente e aponta superiormente. Se o cateter não puder ser avançado diretamente, um fio macio pode ser usado e o cateter posteriormente avançado sobre o fio. Em pacientes que foram submetidos ao switch atrial, um cateter colocado através da veia jugular interna seguirá para a esquerda no ventrículo esquerdo subpulmonar e, em seguida, superiormente nas artérias pulmonares. Em contraste, no paciente com transposição corrigida congenitamente, o cateter entrará no átrio direito, depois no ventrículo esquerdo subpulmonar à direita e, finalmente, na artéria pulmonar principal, que está localizada posterior e à direita da aorta. ¹
FISIOLOGIA UNIVENTRICULAR APÓS CIRURGIA PALIATIVA DE FONTAN: A introdução do procedimento de Fontan revolucionou o cuidado de pacientes com fisiologia de Ventrículo Único. Os primeiros pacientes foram submetidos à chamada conexão atriopulmonar, onde o apêndice atrial direito era cirurgicamente anastomosado ao tronco da artéria pulmonar. Modificações mais recentes do procedimento, como o túnel lateral ou o conduto extracardíaco, incluem o redirecionamento do fluxo da VCI para as artérias pulmonares com uma anastomose feita entre a VCS e as artérias pulmonares (tipicamente a artéria pulmonar direita; a anastomose cavopulmonar ou shunt de Glenn). Conhecer a presença de uma anastomose cavo-pulmonar é importante na obtenção do acesso jugular interno nesses indivíduos, pois o fio-guia pode canular a artéria pulmonar direita e falha em reconhecer essa anatomia pós-operatória única somada com a manipulação descuidada do fio-guia pode levar a lesões nas artérias pulmonares e a implicações catastróficas. 1, 5, 6
Após a paliação de Fontan, o retorno venoso sistêmico ocorre passivamente e o fluxo não pulsátil é visto nas artérias pulmonares e como resultado a hipertensão venosa sistêmica e a redução do fluxo sistêmico são consequências inevitáveis. No entanto, embora se passaram mais de 50 anos desde a descrição inicial de Fontan e cols. em 1971, os dados sobre os valores hemodinâmicos “esperados” ou “normais” para um adulto pós-Fontan ainda são limitados. Vários estudos demonstraram que as pressões de Fontan (isto é, venosa sistêmica) estão associadas a desfechos clínicos piores, normalmente se utilizando como referência uma pressão venosa sistêmica ≥15 mmHg como um achado anormal e associado a piores resultados. Outros relataram que uma pressão venosa central de ≥14 mmHg está associada a piores resultados em sobreviventes tardios após a cirurgia paliativa de Fontan. 5, 6, 7, 8
Acredita-se que a disfunção diastólica do ventrículo único seja universal antes e após a Cirurgia Fontan (em virtude da sobrecarga de volume, cianose e subenchimento ventricular). Semelhante às pressões venosas, os pontos de corte para aumento das pressões de enchimento ventricular não foram estabelecidos, sugerindo-se que PAWP (ou pressão diastólica final do ventrículo sistêmico) ≥12 mmHg seja um marcador de aumento das pressões de enchimento ventricular, associando-se a um aumento de mortalidade cardíaca em adultos pós-Fontan. 7, 8
Por fim, a definição de resistência vascular pulmonar anormal em pacientes pós-Fontan também é controversa e relacionada principalmente as armadilhas associadas ao fluxo pulmonar não pulsátil, sendo que uma resistência vascular pulmonar indexada >2 U/m² é proposta como anormal relacionada a piores desfechos clínicos. 8
CORONARIOGRAFIA EM ADULTOS COM CARDIOPATIA CONGÊNITA
O uso de métodos de imagem não invasivos (Ecocardiograma, Tomografia ou Ressonância) é significativamente útil neste cenário, fornecendo não apenas informações relacionadas à presença de coronárias anômalas, mas também quanto orientação e origem dos óstios coronários, auxiliando, assim, inclusive na seleção do cateter diagnóstico. Isso é particularmente relevante em pacientes com tetralogia de Fallot, nos quais a raiz da aorta é comumente dilatada e rodada no sentido horário em graus variados; como resultado, o óstio da artéria coronária direita é mais anterior do que o normal. A visualização e avaliação adequadas das artérias coronárias e seus trajetos são de importância crítica em pacientes com anormalidades cono-truncais nos quais a intervenção valvar pulmonar percutânea está sendo considerada. Se disponível, imagens tomográficas prévias devem ser usadas para confirmar a permeabilidade das artérias subclávias antes do acesso radial, especialmente em pacientes mais velhos com tetralogia de Fallot ou atresia pulmonar, nos quais uma derivação clássica de Blalock-Taussig pode ter sido usada. ¹
A anatomia coronariana em pacientes com transposição das grandes artérias corrigida congenitamente também precisa ser destacada. Embora raros na prática clínica, esses pacientes são comumente uma fonte de confusão quando encaminhados para cineangiocoronariografia. Nesta patologia, as artérias coronárias alimentam seus respectivos ventrículos. Portanto, a artéria Descendente Anterior esquerda e a artéria Circunflexa esquerda surgirão do seio de Valsalva direito, alimentando o ventrículo esquerdo subpulmonar do lado direito. Da mesma forma, uma grande artéria Coronária Direita com ramos marginais agudos proeminentes surgirá do seio de Valsalva esquerdo, fornecendo fluxo para o ventrículo direito sistêmico hipertrofiado. Do ponto de vista técnico, o óstio do Tronco da Coronária esquerda e o óstio Coronário direito podem ser tipicamente canulados com cateteres Judkins direito e esquerdo, respectivamente, ou qualquer outro cateter comumente usado em pacientes sem cardiopatia congênita. ¹
Referências:
1. Miranda WR, Aboulhosn JA, Hagler DJ. Catheterization in Adults With Congenital Heart Disease: A Primer for the Noncongenital Proceduralist. JACC Cardiovasc Interv. 2022 May 9;15(9):907-921. doi: 10.1016/j.jcin.2021.12.020. PMID: 35512915.
2. Elliott M. Antman, James D. Marsh, Laurence H. Green, William Grossman. Blood oxygen measurements in the assessment of intracardiac left to right shunts: A critical appraisal of methodology, The American Journal of Cardiology, Volume 46, Issue 2, 1980, Pages 265-271, ISSN 0002-9149,
(https://doi.org/10.1016/0002-9149(80)90068-5.) (https://www.sciencedirect.com/science/article/pii/0002914980900685)
3. Karen K. Stout, Curt J. Daniels, Jamil A. Aboulhosn, Biykem Bozkurt, Craig S. Broberg, Jack M. Colman, Stephen R. Crumb, Joseph A. Dearani, Stephanie Fuller, Michelle Gurvitz, Paul Khairy, Michael J. Landzberg, Arwa Saidi, Anne Marie Valente, George F. Van Hare, 2018 AHA/ACC Guideline for the Management of Adults With Congenital Heart Disease: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines, Journal of the American College of Cardiology, Volume 73, Issue 12, 2019, Pages 1494-1563, ISSN 0735-1097,
(https://doi.org/10.1016/j.jacc.2018.08.1028.) (https://www.sciencedirect.com/science/article/pii/S0735109718368451)
4. Elisa A. Bradley, Naser Ammash, Sara C. Martinez, Kelly Chin, Camden Hebson, Harsimran S. Singh, Jamil Aboulhosn, Jasmine Grewal, Joseph Billadello, Murali M. Chakinala, Curt J. Daniels, Ali N. Zaidi, Treat-to-close: Non-repairable ASD-PAH in the adult: Results from the North American ASD-PAH (NAAP) Multicenter Registry, International Journal of Cardiology, Volume 291, 2019, Pages 127-133, ISSN 0167-5273, (https://doi.org/10.1016/j.ijcard.2019.03.056)
(https://www.sciencedirect.com/science/article/pii/S0167527318346606)
5. Miranda, W.R., Borlaug, B.A., Hagler, D.J., Connolly, H.M. and Egbe, A.C. (2019), Haemodynamic profiles in adult Fontan patients: associated haemodynamics and prognosis. Eur J Heart Fail, 21: 803-809.
(https://doi.org/10.1002/ejhf.1365)
6. Alsaied, T., Rathod, R. H., Aboulhosn, J. A., Budts, W., Anderson, J. B., Baumgartner, H., Brown, D. W., Cordina, R., Dudekem, Y., Ginde, S., Goldberg, D. J., Goldstein, B. H., Lubert, A. M., Oechslin, E., Opotowsky, A. R., Rychik, J., Schumacher, K. R., Valente, A. M., Wright, G., and Veldtman, G. R. (2021) Reaching consensus for unified medical language in Fontan care. ESC Heart Failure, 8: 3894– 3905.
(https://doi.org/10.1002/ehf2.13294)
7. Miranda, WR, Hagler, DJ, Taggart, NW, Borlaug, BA, Connolly, HM, Egbe, AC. Elevated ventricular filling pressures and long-term survival in adults post-Fontan. Catheter Cardiovasc Interv. 2020; 95: 803– 809.
(https://doi.org/10.1002/ccd.28340)
8. Alexander C. Egbe, MBBS, MPH, Heidi M. Connolly, MD, William R. Miranda, MD, Naser M. Ammash, MD, Donald J. Hagler, MD, Gruschen R. Veldtman, MD, and Barry A. Borlaug, MD. Hemodynamics in Fontan Failure, Circulation: Heart Failure. 2017; 10:e004515.
(https://doi.org/10.1161/CIRCHEARTFAILURE.117.004515)