Boletim Informativo Nº 51
Download
Dr. Pedro Pio da Silveira
Aneurismas intracranianos não rotos são dilatações patológicas nas principais ramificações das artérias cerebrais. Os aneurismas saculares são responsáveis pela maioria das hemorragias subaracnóideas, embora aneurismas fusiformes e micóticos possam ser identificados em pacientes selecionados. Os aneurismas saculares são protrusões, de paredes finas, das artérias intracranianas, compostos por uma túnica média muito fina ou ausente e uma lâmina elástica interna ausente ou gravemente fragmentada. Os aneurismas fusiformes consistem no aumento ou dilatação de toda a circunferência do vaso. Aneurismas micóticos geralmente resultam de êmbolos infectados devido a endocardite infecciosa.
Afetam 3 a 5% da população adulta, independentemente da localização geográfica ou etnia. Desenvolvem-se após a segunda década de vida – mais frequentemente entre a quarta e sexta décadas – e são mais prevalentes em mulheres do que em homens. Em aproximadamente 20 a 30% dos casos são múltiplos. Menos de 5% dos pacientes são crianças e os fatores de risco e mecanismos de formação diferem substancialmente entre crianças e adultos. Em crianças, 50 a 70% são causados por trauma, infecção ou dissecções; apenas 20 a 30% têm forma sacular, e a maioria é clinicamente sintomática. A ruptura de um aneurisma intracraniano resulta em hemorragia subaracnóidea (HSA), que tem prognóstico ruim em até 35% dos pacientes.
Melhorias feitas na qualidade dos métodos de diagnóstico por de imagem, dentre eles ressonância magnética e tomografia computadorizada, aumentaram nas últimas duas décadas. Como consequência, aneurismas intracranianos são detectados com mais frequência e, dessa forma, os médicos estão cada vez mais confrontados com o dilema em relação à escolha do manejo clínico adequado, a saber, tratamentos preventivos (endovasculares ou cirúrgicos) ou tratamento conservador.
A incerteza em torno do tratamento dos aneurismas intracranianos é consequência dos dados conflitantes entre a patogênese e o risco de ruptura. A formação dos aneurismas é gradual. Fatores hemodinâmicos prejudiciais, como estresse hemodinâmico e agressão vascular direta (incluindo hipertensão, acúmulo de lipídios, arteriosclerose e tabagismo), somados a uma predisposição genética, estão entre as principais hipóteses para a gênese dos aneurismas. A formação de aneurismas intracranianos é influenciada pela interação complexa entre fatores genéticos e ambientais, embora nenhum gene específico tenha sido identificado. Por exemplo, entre indivíduos com história familiar de aneurismas intracranianos, fumantes têm um risco três vezes maior.
Aneurismas intracranianos não são uma doença congênita, mas se desenvolvem ao longo da vida, e são extremamente raros em pacientes com 20 anos de idade. A probabilidade é aumentada em pessoas com um parente de primeiro grau diagnosticado com aneurisma intracraniano ou HSA (OR 3,4, IC 95% 1,9-5,9).
As paredes das artérias cerebrais são estruturalmente distintas daquelas de artérias extracranianas, pois têm uma adventícia esparsa e uma proporção menor de fibras elásticas. Além disso, as artérias cerebrais estão imersas no líquido cefalorraquidiano do espaço subaracnóide, ao invés de tecido conjuntivo. Estes fatores estruturais tornam as artérias cerebrais suscetíveis à formação de aneurismas.
Na parede de uma artéria cerebral saudável, a lâmina elástica interna mantém a elasticidade e integridade estrutural da parede do vaso em uma região de bifurcação arterial. Degeneração ou ruptura da lâmina elástica interna na região da bifurcação é um evento chave na formação do aneurisma. A causa definitiva dessa degeneração e porque isso só ocorre em certos indivíduos, no entanto, permanece obscuro.
Uma vez que os mecanismos moleculares falham em compensar a sobrecarga mecânica da parede do vaso e lesão miointimal, a resposta inflamatória celular e humoral tornam-se os principais impulsionadores da formação aneurismática. Essas respostas, que são mediadas por citocinas inflamatórias, como o fator de necrose tumoral (TNF), interleucina 1β e metaloproteinases de matriz, promovem o influxo de macrófagos e contínua degradação de fibras de colágeno e elastina.
Aneurismas intracranianos podem permanecer inalterados por muito tempo, antes passando por episódios de crescimento rápido, durante os quais são mais propensos a ruptura. Simulações matemáticas derivadas de coortes prospectivas e dados de análises moleculares sugerem que o crescimento do aneurisma é descontínuo e estocástico em vez de linear.
Assim, deve-se ressaltar que nem todos os aneurismas intracranianos têm uma vida longa; alguns desenvolvem-se e rompem-se em um curto período, ou seja, dentro de semanas ou meses. Em uma análise de 557 pacientes de três estudos prospectivos, 12% dos 734 aneurismas intracranianos não rotos, incluídos na análise, demonstraram crescimento durante o seguimento (duração média de 2,7 anos). Esses achados enaltecem a necessidade de acompanhamento para pacientes tratados de forma conservadora.
O crescimento do aneurisma é refletido em mudanças na imagem radiológica – e, portanto, macroscópica – mas também ocorrem mudanças estruturais nos níveis microscópico e molecular. Consequentemente, mudanças estruturais potencialmente significativas que ocorrem além do nível macroscópico permanecem indetectáveis durante o acompanhamento de rotina.
Os principais fatores de risco para o crescimento do aneurisma são tabagismo, sexo feminino, hipertensão arterial sistêmica, tamanho inicial do aneurisma, aneurismas múltiplos, aneurisma multilobado, aneurisma oblongo, aneurisma de circulação posterior.
A importância do tabagismo foi ilustrada em uma análise de caso controle de 45 homens e 70 mulheres com HSA entre as idades de 35 e 64 anos. Os fumantes tiveram um risco significativamente maior de HSA em comparação com uma população de controle; o risco relativo para homens e mulheres foi de 3,0 e 4,7, respectivamente, e o risco aumentou com o número de cigarros fumados. Aqueles que fumavam e tinham hipertensão tiveram um aumento de quase 15 vezes no risco de HSA em comparação com os não fumantes normotensos.
O mecanismo pelo qual o tabagismo predispõe à formação de aneurisma pode envolver a diminuição da eficácia da alfa-1 antitripsina, um importante inibidor de proteases como a elastase.
A associação entre hipertensão e formação e ruptura de aneurismas tem sido controversa, embora o balanço das evidências sugira que a hipertensão seja um fator de risco.
Como já dito anteriormente, há uma preponderância do sexo feminino quanto aos aneurismas intracranianos, variando de 54 a 61%. Em relação ao período pré e pós menopausa, a deficiência de estrogênio da menopausa causa uma redução no conteúdo de colágeno dos tecidos. Em populações com mais de 50 anos, o aumento da prevalência em mulheres pode aproximar-se de uma proporção de 2:1 ou mais em relação ao sexo masculino. Essa perda de colágeno pode contribuir para o desenvolvimento de aneurismas, de forma análoga à situação em pacientes com doenças do tecido conjuntivo. Em um estudo de caso controle, mulheres na pré-menopausa sem histórico de tabagismo ou hipertensão apresentaram risco reduzido de HSA em comparação com mulheres pós menopáusicas de mesma idade (odds ratio 0,24). Além disso, o uso de terapia de reposição de estrogênio foi associado a um risco reduzido de HSA em mulheres na pós menopausa (odds ratio 0,47).
O papel dos fatores genéticos na patogênese da formação do aneurisma intracraniano é apoiado por estudos que encontraram um risco aumentado em pacientes com alguma síndrome hereditária conhecida e pela ocorrência de aneurismas nas famílias. Alguma síndrome hereditária costuma estar presente quando os aneurismas são diagnosticados em mais de um membro da família.
Os distúrbios hereditários associados à presença de aneurisma intracraniano incluem:
- Doenças do tecido conjuntivo, como síndrome de Ehlers-Danlos e pseudoxantoma elástico: O mecanismo pelo qual as doenças do tecido conjuntivo predispõe à formação de aneurisma envolve a fraqueza da parede arterial exposta ao padrão de fluxo não laminar do sangue, que é então exposta a tensões de cisalhamento.
- Síndrome de Moyamoya: Embora a maioria dos casos de Moyamoya sejam esporádicos, provavelmente há uma suscetibilidade genética subjacente à doença, e a ocorrência familiar é conhecida.
- Aneurismas familiares – Os familiares de pacientes com aneurismas intracranianos têm maior risco de ter um aneurisma, mesmo na ausência de uma síndrome hereditária conhecida.
Os aneurismas familiares tendem a se romper em um tamanho menor e mais jovem do que os aneurismas esporádicos. Os irmãos frequentemente experimentam a ruptura na mesma década de vida. Os aneurismas tendem a ocorrer em locais semelhantes dentro das famílias, sugerindo que uma vulnerabilidade anatômica específica pode ser herdada.
A maioria dos aneurismas intracranianos (aproximadamente 85%) está localizada na circulação anterior, predominantemente no polígono de Willis. Os locais mais comuns incluem a junção da artéria comunicante anterior com a artéria cerebral anterior, a junção da artéria comunicante posterior com a artéria carótida interna e a bifurcação da artéria cerebral média. Os locais da circulação posterior geralmente incluem o topo da artéria basilar; a junção da artéria basilar e as artérias cerebelares superior ou anterior inferior; a junção da artéria vertebral e a artéria cerebelar inferior posterior.
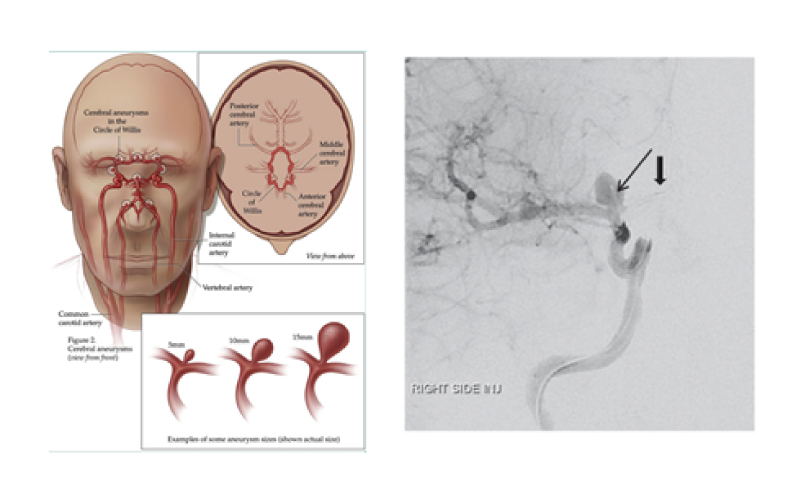
O manejo dos aneurismas intracranianos não rotos é controverso. Não há ensaios clínicos randomizados nos quais basear as recomendações. As decisões sobre a terapia precisam pesar a história natural do aneurisma, os riscos da intervenção e as preferências do paciente.
Uma revisão sistemática e metanálise dos estudos observacionais disponíveis incluiu 60 estudos, 9.845 pacientes e 10.845 aneurismas. A mortalidade geral associada à clipagem cirúrgica foi de 1,7%; desfechos desfavoráveis ocorreram em 6,7%. Estudos observacionais, que compararam os riscos do reparo cirúrgico versus endovascular, em geral encontraram taxas mais baixas de resultados ruins em pacientes tratados com o reparo endovascular.
No estudo internacional ISUIA (Study of Unruptured Intracranial Aneurysms), as taxas de desfecho neurológico insatisfatório em um ano foram de 12,6 e 9,8% para aqueles tratados cirurgicamente e endovascularmente, respectivamente. Em outro estudo de coorte, o reparo endovascular foi associado a mortalidade mais baixa (0,6 vs. 1,6%) e taxas mais baixas de AVC (4,3 vs. 9,0%).
A idade é um elemento crucial na decisão de tratar um aneurisma não roto. A morbidade e a mortalidade aumentam nos pacientes maiores de 50 anos no grupo tratado cirurgicamente, versus nos maiores de 70 anos no grupo tratado endovascularmente.
Os investigadores do ISUIA (Study of Unruptured Intracranial Aneurysms) concluíram que, em pacientes sem história de hemorragia subaracnóidea, é improvável que qualquer terapia seja capaz de melhorar a história natural de aneurismas menores que 7 mm. Os pesquisadores também apontaram para os grupos específicos de pacientes que tem maior benefício de intervenção, por exemplo pacientes com menos de 50 anos com aneurismas da artéria comunicante posterior entre 7 a 24 mm.
O tratamento de aneurismas intracranianos não rotos também foi avaliado por estudos que realizaram análises de custo efetividade. Um desses estudos verificou que o tratamento de aneurismas assintomáticos <10 mm de diâmetro em pacientes sem história de HSA piorou os desfechos clínicos; já o tratamento de aneurismas não rotos >10 mm, sintomáticos ou com história de HSA foi custo efetivo.
Uma análise posterior de custo efetividade comparou o tratamento cirúrgico ou endovascular com tratamento conservador. As seguintes observações foram relatadas:
Para pacientes com 50 anos de idade, o tratamento foi ineficaz ou não foi rentável para aneurismas com as seguintes características:
1) Pequeno (<7 mm), devido ao baixo risco de ruptura.
2) Localizado na artéria carótida cavernosa.
3) Grande (> 25 mm) e localizado na circulação posterior, devido ao alto risco de complicações do tratamento.
Para pacientes de 40 anos de idade, o tratamento foi ineficaz ou não foi rentável para aneurismas com as seguintes características:
1) Pequeno (<12 mm) ou grande (> 25 mm) e localizado na artéria carótida cavernosa.
2) Pequeno (<7 mm) e localizado na circulação anterior.
Os estudos disponíveis enfatizam a necessidade de examinar cada caso individualmente, considerando fatores como comorbidades, idade do paciente, tamanho e localização do aneurisma e riscos do tratamento. A soma desses dados apoia o manejo expectante de aneurismas saculares muito pequenos, particularmente quando tais aneurismas estão localizados na circulação anterior ou quando são detectados em pacientes mais velhos. Por exemplo, o tratamento de pequenos aneurismas incidentais da artéria carótida interna intracavernosa geralmente não é indicado. Para grandes aneurismas intracavernosos sintomáticos, a decisão de tratamento deve ser individualizada com base na idade do paciente, gravidade e progressão dos sintomas e alternativas de tratamento. O maior risco de tratamento e menor expectativa de vida em idosos deve ser considerado em todos os pacientes e favorece a observação em pacientes idosos com aneurismas assintomáticos.
Aneurismas intradurais sintomáticos de todos os tamanhos devem ser considerados para tratamento com relativa urgência. Aneurismas coexistentes ou remanescentes, de todos os tamanhos, em pacientes com HSA devido a outro aneurisma tratado, justificam consideração para tratamento.
Os aneurismas localizados no topo da artéria basilar apresentam um risco relativamente alto de ruptura. As decisões de tratamento devem levar em consideração a idade do paciente, a condição médica e neurológica existente e os riscos relativos de reparo. Se for tomada a decisão de observação, reavaliação periódica com angiotomografia, angiorressonância ou angiografia deve ser considerada.
Dado o aparente baixo risco de hemorragia de aneurismas incidentais pequenos (<7 mm) em pacientes sem HSA prévia, a observação em vez da intervenção é geralmente recomendada. No entanto, consideração especial para o tratamento deve ser dada a pacientes jovens (<50 anos).
Aneurismas assintomáticos entre 7 a 10 mm de diâmetro justificam forte consideração para o tratamento, levando em consideração a idade do paciente, condições médicas e neurológicas existentes e riscos relativos para o tratamento.
Raros pacientes têm um aneurisma intracraniano associado a uma malformação arteriovenosa intracraniana (MAV). Esses aneurismas têm maior probabilidade de estar associados a crescimento e ruptura do que os aneurismas em geral. Portanto, é recomendado reparar o aneurisma antes de tratar a MAV.
Os aneurismas intracranianos parecem ser mais comuns do que o esperado em uma população de pacientes com doença arterial carotídea sintomática, talvez devido a fatores de risco compartilhados. Os aneurismas distais a uma estenose da artéria carótida interna podem ser suscetíveis a alterações hemodinâmicas súbitas com a endarterectomia carotídea e podem romper-se. Por outro lado, a clipagem cirúrgica de um aneurisma distal a uma estenose carotídea pode aumentar o risco de acidente vascular cerebral isquêmico. Infelizmente, os dados para esta situação são muito esparsos para permitir conclusões firmes sobre qual problema deve ser abordado primeiro.
Pacientes com aneurismas intracranianos podem requerer terapia antitrombótica para o tratamento de outras condições, como fibrilação atrial. Os dados disponíveis são limitados, um tanto conflitantes e não suficientes para determinar se a terapia anticoagulante ou antiplaquetária aumenta o risco de ruptura do aneurisma. A terapia anticoagulante parece aumentar a gravidade da ruptura, caso ela ocorra.
Por fim, pacientes que não são tratados definitivamente, seja com cirurgia aberta ou métodos endovasculares, as seguintes recomendações são feitas para monitoramento:
1) Realização anual de angiotomografia ou angiorressonância por dois a três anos, e a cada dois a cinco anos a partir de então, se o aneurisma for clínica e radiograficamente estável.
2) É razoável reestudo em seis meses de pequenos aneurismas recém detectados, uma vez que há evidências de que pequenos aneurismas recém formados podem ter maior risco de ruptura do que aneurismas mais antigos e estáveis. Intervalos mais longos são apropriados se o estudo de seis meses não mostrar nenhuma mudança significativa.
3) Os pacientes devem ser instruídos a evitar fumar, consumo excessivo de álcool, medicamentos estimulantes, drogas ilícitas, esforço excessivo e manobras de Valsalva.
4) Os pacientes cujo aneurisma é tratado correm o risco de formação de aneurisma recorrente e requerem monitoramento.
O tratamento endovascular parece estar associado a menor morbidade e mortalidade do que a clipagem cirúrgica e está desempenhando um papel cada vez maior no tratamento dos aneurismas intracranianos não rotos. Novas tecnologias, como o desvio de fluxo através de stents (stents diversores de fluxo), melhoraram a segurança do tratamento endovascular e permitiram que aneurismas, antes considerados inacessíveis ou tecnologicamente difíceis para tal tratamento, sejam submetidos ao tratamento, assim como veremos nos “próximos capítulos”!